
脐带血中的“诺奖细胞” 可为免疫反应“踩刹车”
发布时间 / 2025-10-14 / 884
据央视新闻报道1,当地时间10月6日,瑞典卡罗琳医学院宣布,将2025年诺贝尔生理学或医学奖授予科学家玛丽·E·布伦科(Mary E. Brunkow)、弗雷德·拉姆斯德尔(Fred Ramsdell)和坂口志文(Shimon Sakaguchi),表彰他们在外周免疫耐受机制方面的研究贡献。

图1 三位诺贝尔生理学或医学奖得主
人体的免疫系统非常强大,但如果不加以调节,它可能会攻击自身的器官。日本科学家坂口志文发现了一种叫“调节性T细胞”(Tregs)的特殊细胞,它们能够有效防止免疫系统攻击自身的正常细胞。
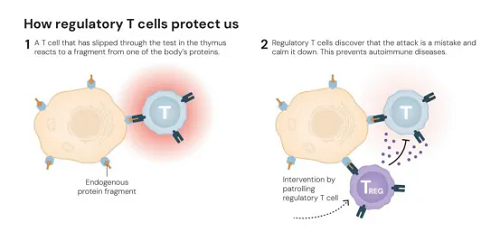
图2 Treg是如何保护我们的
图片来源 The Nobel Prizes官网
而美国科学家玛丽·布伦科和弗雷德·拉姆斯德尔基于长期对FOXP3基因的研究,进一步印证了坂口的判断。这三位科学家的研究成果,帮助我们更好地理解了免疫系统是如何工作的,同时推动了对自身免疫疾病等方面的研究。
脐带血来源的Tregs有什么优势?
脐带血来源的Tregs(UCB-Tregs)是指从脐带血中分离和扩增的调节性T细胞,它是一类具有免疫抑制功能的特殊T细胞亚群,在维持免疫耐受和调控过度免疫反应中发挥关键作用。
研究表明,UCB-Tregs相比成人外周血来源的Tregs有一些特别的优点2:
① “工作能力”强。UCB-Tregs细胞具有更高的受体多样性和谱系稳定性,这意味着它们能更多样化地工作。
② 更好的扩增潜力。这些细胞中有更多的幼稚型T细胞,端粒较长,这使得它们在体外扩增时更有潜力。
③ 强效抗炎。UCB-Tregs细胞的表型更加均一,含有较少的促炎性细胞亚群,减少了可能的炎症反应。
UCB-Tregs的临床应用前景
目前,UCB-Tregs在多种疾病的临床研究中显示出良好的前景,特别是在移植物抗宿主病(GvHD)和自身免疫性疾病领域。
GvHD是一种免疫反应性疾病,主要发生在异基因造血干细胞移植后。当供体的免疫细胞(尤其是T细胞)识别受体的组织为“异己”时,会攻击宿主的器官和组织,导致炎症和损伤。

图3 科学家利用UCB-Tregs预防GvHD
在GvHD预防中的研究,一项临床试验显示3,接受UCB-Tregs输注的患者急性GvHD(II-Ⅳ级)的100天累积发生率仅为9%,显著低于对照组的45%。重要的是,Tregs治疗组未观察到剂量限制性毒性,且感染密度、造血恢复和非复发死亡率与对照组相当。长期随访显示,Tregs组患者1年慢性GvHD发生率为0%,而对照组为14%。

图4 UCB-Tregs在治疗糖尿病方面的研究
在自身免疫性疾病治疗方面,UCB-Tregs在治疗糖尿病方面也显示出潜力。研究发现4,UCB-Tregs的抑制功能与患者病程呈负相关,且高抑制组患者在12个月随访期间表现出更好的治疗反应。
渐冻症(肌萎缩侧索硬化症,ALS)是一种罕见且致命的神经退行性疾病,患者多在确诊后2~5年内因呼吸衰竭离世,目前缺乏有效的治疗手段。
2020—2022年,美国哥伦比亚大学、MD安德森癌症中心和德州农工大学的研究人员发现神经炎症与渐冻症密切相关,渐冻症患者自身的Tregs数量锐减、功能受损,抗炎失效,致病情快速恶化。

图5 该研究被发表在权威医学杂志《新英格兰医学杂志》子刊循证上
基于这一发现,研究人员开展了UCB-Tregs治疗ALS的研究5。试验共招募了6例ALS患者,均采用固定剂量且无需HLA配型的冷冻保存UCB-Tregs进行干预,给药方案设定为前期4周内每周输注1次,后续6个月每月输注1次。结果显示,所有患者均未出现严重副作用,治疗过程安全。在可被评估的4名患者中,有3人的病情恶化速度显著放缓。此外,其中2名患者的神经受损状况有所缓解。
图6 刚采集到的脐带血
脐带血来源的调节性T细胞因其独特的生物学特性和良好的表现,成为具有发展潜力的“明星细胞”。随着扩增技术的优化和临床研究的深入,UCB-Tregs有望在GvHD、自身免疫性疾病等领域发挥更大作用。
参考文献:
[1]郝晓丽. (2025, 10月6日). 2025年诺贝尔生理学或医学奖揭晓. 央视网. https://news.cctv.com/2025/10/06/ARTIBF0JHz5gXX9zrsb6xTbb251006.shtml
[2]Motwani, K., Peters, L. D., Vliegen, W. H., El-Sayed, A. G., Seay, H. R., Lopez, M. C., Baker, H. V., Posgai, A. L., Brusko, M. A., Perry, D. J., Bacher, R., Larkin, J., Haller, M. J., & Brusko, T. M. (2020). Human regulatory T cells from umbilical cord blood display increased repertoire diversity and lineage stability relative to adult peripheral blood. *Frontiers in Immunology, 11*, 611. https://doi.org/10.3389/fimmu.2020.006
[3]Brunstein, C. G., Miller, J. S., McKenna, D. H., Hippen, K. L., DeFor, T. E., Sumstad, D., Curtersinger, J., Verneris, M. R., MacMillan, M. L., Levine, B. L., Riley, J. L., June, C. H., Le, C., Weisdorf, D. J., McGlave, P. B., Blazar, B. R., & Wagner, J. E. (2016). Umbilical cord blood-derived T regulatory cells to prevent GVHD: Kinetics, toxicity profile, and clinical effect. Blood, 127(8), 1044–1051. https://doi.org/10.1182/blood-2016-04-711275
[4]Bi, Y., Kong, R., Peng, Y., Cai, D., Zhang, Y., Yang, F., Li, X., Deng, W., Liu, F., He, B., Cao, C., Deng, C., Tang, X., Fan, L., Yu, H., & Zhou, Z. (2024). Multiply restimulated human cord blood-derived Tregs maintain stabilized phenotype and suppressive function and predict their therapeutic effects on autoimmune diabetes. Diabetology & Metabolic Syndrome, 16(71), 1-11.
[5]Shneider, N. A., Nesta, A. V., Rifai, O. M., Yasek, J., Elyaman, W., Aziz-Zaman, S., Lyu, M.-A., Levy, S. H. S., Hoover, B. N., Vlad, G., Huang, M., Zeng, K., Sadeghi, T., Reddy, A., Flowers, C. R., & Parmar, S. (2025). Clinical safety and preliminary efficacy of regulatory T cells for ALS. NEJM Evidence, 4(5). https://doi.org/10.1056/EVIDa2400249
相关链接您可能也感兴趣…
发布时间:2022年04月15日
《亲爱的小孩》故事原型曾回四川感恩 脐血库专...
发布时间:2014年02月26日
瑞典医生成功以干细胞培养血管再植回人体
发布时间:2024年01月10日
24小时内完成任务 这份四川脐带血上演“生命...