
治疗新生儿缺氧缺血性脑病,孩子自己的“原厂配件”或能帮上忙
发布时间 / 2025-10-16 / 875
新生儿缺氧缺血性脑病(HIE)是指因围生期窒息导致胎儿或新生儿脑部出现部分或完全缺氧、脑血流减少或暂停,进而引发的脑损伤性疾病。

在我国,足月儿缺氧缺血性脑病(HIE)的发病率处于3‰~6‰的水平,即每千名活产婴儿中约有3~6例罹患此病。值得注意的是,该疾病不仅导致15%~20%的患儿在新生儿期夭折,且在存活群体中,仍有25%~30%可能遗留长期后遗症[1]。
HIE引发多种急慢性健康损害:急性期常表现为癫痫发作、意识状态异常、呼吸功能不全、肌张力低下及代谢失调;而存活患儿中,脑瘫、反复癫痫、智力障碍等慢性神经系统损伤以及行为发育异常等远期并发症亦较为常见[2]。
目前,HIE的治疗原则为支持性重症监护、控制性惊厥发作和亚低温等神经保护措施[3]。遗憾的是,这些方法并不能修复、再生受损的神经细胞,只有不超过50%的新生儿获得改善[4]。
因此,科学家们正尝试利用脐带间充质干细胞(UC-MSCs)治疗HIE。
完美的“原厂配件”
间充质干细胞是一类具有自我更新能力和多向分化潜能的成体干细胞。
新生儿出生后,从废弃的脐带组织中分离出的间充质干细胞就是脐带间充质干细胞。
脐带间充质干细胞具有采集简单、增殖能力强、分化潜能高、免疫原性低,同时具有纯净、无伦理道德限制、易于大规模制备等众多特点。
对于科研人员来说,这种干细胞简直“堪称完美”[5]。
UC-MSCs修复神经的机制
科学家们已经证实,UC-MSCs通过多种途径发挥神经修复的作用:
①旁分泌效应:分泌神经营养因子和抗炎因子,抑制神经炎症,促进神经元存活和突触重塑[6]。
②免疫调节:下调促炎细胞因子,增加调节性T细胞比例,减轻脑内免疫损伤[7]。
③促进血管生成:通过释放VEGF等因子改善脑血流,修复缺血区域微循环[8]。
④分化为神经细胞:在动物模型中分化为神经元样细胞,替代损伤细胞[9]。
UC-MSCs治疗HIE临床研究进展
2019年,美国杜克大学医学院新生儿科进行了一项临床Ⅰ期试验(NCT03635450),采用脐带间充质干细胞联合亚低温治疗中重度HIE。

论文发表在《Stem Cells Translational Medicine》期刊上
研究中使用的脐带间充质干细胞由美国食品药品监督管理局(FDA)批准的、符合FACT标准的脐带血库提供。
6名中重度HIE新生儿(4名中度,2名重度)接受了标准亚低温治疗,并在出生后48小时内接受UC-MSCs输注治疗(2×106 /kg),其中3位在2月龄追加一次UC-MSCs输注。
研究结果显示,输注UC-MSCs联合亚低温治疗中重度HIE新生儿安全可行,无严重不良反应,神经发育结局乐观。

土耳其健康科学大学加齐奥斯曼帕夏教学研究医院主导的研究
在另一项针对严重HIE的临床Ⅰ期研究中,土耳其研究人员对6例1至12岁的患儿实施了UC-MSCs输注治疗。该临床研究采用鞘内、静脉及肌肉三重给药途径,以每月2次的频率持续2个月给药,剂量为1×106 /kg/次。
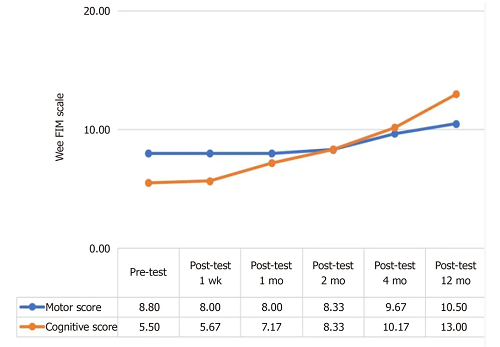
输注UC-MSCs运动和认知能力改善情况
输注UC-MSCs后,HIE患儿运动功能(评估肢体活动能力)和认知能力(评估思维、交流和学习能力)得到改善,12个月时认知评分提升136%,运动评分提升31%。
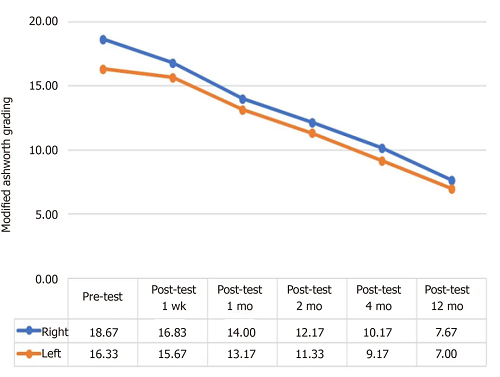
输注UC-MSCs后,肌张力改善情况
上图展示6名患儿在输注UC-MSCs后,肌张力改善情况(分数越高表示肌痉挛越严重)。研究显示,肌张力持续改善,且改善速度在治疗后1个月加速。这表示UC-MSCs通过抗炎和神经修复机制,有效减轻了HIE导致的痉挛状态。
结果表明[10],三重途径多次输注UC-MSCs治疗儿童HIE安全可行,且能持续改善神经功能与生活质量,为后续Ⅱ期试验奠定基础。
HIE是一种严重威胁婴幼儿健康的疾病,其高发病率与高致残率已构成我国新生儿医学领域的重要难题。目前的治疗方法难以修复受损的神经细胞,致使许多患儿落下终身残疾。然而,脐带间充质干细胞(UC-MSCs)疗法的引入为这一困局提供了突破性的希望——它通过分泌神经营养因子、调节免疫反应、促进血管生成及定向分化等多种机制,展现出显著的神经修复潜力。特别引人关注的是,采用脐带间充质干细胞进行干预,因其无排异风险且随时可用的独特优势,堪称孩子完美的“原厂配件”。
年轻准父母在迎接新生命之际,若决定留存这份生物资源,为孩子打造专属的健康防护,或许将重塑家庭的命运走向。
参考文献:
[1] 顺义区妇儿医院新生儿科团队 . 《一场惊心动魄的相遇 一份念念不忘的恩情》. 顺义区妇幼保健院官网 , 2022年5月27日
[2]ShahP,PerlmanM.Timecoursesofintrapartumasphyxia:neonatalcharacteristicsandoutcomes[J].AmJPerinatol,2009,26(1):39-44.
[3] Lai MC,Yang SN. Perinatal hypoxic-ischemic encephalopathy[J].J Biomed Biotechnol, 2011, 2011:609813.
[4] ShankaranS.Current status of hypothermia for hypoxemic ischemia ofthe newborn [J].Indian J Pediatr,2014,81(6):578-584.
[5] Ding, S., Zhang, H., & Zhu, H. (2022). 脐带来源的华通氏胶间充质干细胞的分离、特性及应用前景 [Isolation, characteristics and application prospects of Wharton's jelly-derived mesenchymal stem cells from umbilical cord]. 癌变·畸变·突变, 34(3),
[6] Cotten, C. M., Fisher, K., Malcolm, W., et al. (2019). A pilot phase I trial of allogeneic umbilical cord tissue-derived mesenchymal stromal cells in neonates with hypoxic-ischemic encephalopathy. Stem Cells Translational Medicine, 8(8), 785–796.
[7] Liu, M., Rao, W., Han, B., et al. (2019). Immunomodulatory characteristics of human umbilical cord mesenchymal stem cells in vitro. Chinese Journal of Tissue Engineering Research, 23(25), 4031–4036.
[8] Wang, S., Cheng, H., Dai, G., et al. (2013). Umbilical cord mesenchymal stem celltransplantation significantly improves neurological function in patients with sequelae of traumatic brain injury. Brain Research, 1532, 76–84.
[9] Sun, J. M., Case, L. E., McLaughlin, C., et al. (2022). Motor function and safety after allogeneic cord blood and cord tissue-derived mesenchymal stromal cells in cerebral palsy: An open-label, randomized trial. Developmental Medicine & Child Neurology, 64(12), 1477–1486.
[10] Kabatas, S., Civelek, E., Savrunlu, E. C., Kaplan, N., Boyali, O., Diren, F., Can, H., Genc, A., Akkoc, T., & Karaoz, E. (2021). Feasibility of allogeneic mesenchymal stem cells in pediatric hypoxic-ischemic encephalopathy: Phase I study. *World Journal of Stem Cells*, *13*(5), 470–484. https://doi.org/10.4252/wjsc.v13.i5.470