
Cell Stem Cell:核移植技术重编程能力比诱导型多能干细胞技术更
发布时间 / 2014-02-26 / 9338
2013年11月21日,高绍荣博士实验室在《Cell Stem Cell》杂志在线发表题为“Pluripotent cells reprogrammed via nuclear transfer show enhanced telomere rejuvenation relative to induced pluripotent stem cells”的文章。
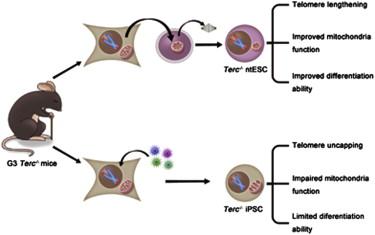
核移植(somatic cell nuclear transfer)和诱导型多能干细胞(iPSCs)是体细胞重编程的两种最主要的技术手段。核移植技术与诱导型多能干细胞的重编程能力是否存在差异一直是人们非常关注的问题。2009年,高绍荣实验室通过四倍体互补实验,获得了全部由iPS细胞发育而来的小鼠,证明了诱导型多能干细胞和核移植胚胎干细胞一样具有真正的多能性。但是,这是以健康个体来源的体细胞作为供体细胞的情况。未来的体细胞重编程应用于临床研究时,主要面向的是病人而非健康个体。那么在以有缺陷的细胞作为供体细胞时,核移植技术和诱导型多能干细胞的重编程能力又是否存在差异呢?
本文中,作者利用端粒酶敲除(Terc-/-)小鼠作为模型来模拟人类衰老过程中发生的端粒和线粒体功能障碍。端粒和线粒体功能障碍对于衰老相关的疾病的发生有重要的影响。作者分别建立了Terc-/-小鼠的核移植胚胎干细胞系(ntESCs)和诱导型多能干细胞系(iPSCs)。与Terc-/- iPS细胞系相比,Terc-/- ntES细胞系表现出更强的分化能力和自我更新能力。他们发现在核移植克隆胚胎的发育过程中端粒有显着的延长,而在iPSCs诱导过程中端粒的长度没有显着的变化。Terc-/- ntES细胞的端粒功能较来源的体细胞有明显的改善,而Terc-/- iPS细胞的端粒功能较来源的体细胞发生进一步的损伤,表现为极短端粒和染色体末端连接的比例增加。此外,Terc-/- iPS细胞的线粒体功能也发生了进一步的损伤,Terc-/- iPS细胞的线粒体呼吸能力下降,细胞内大量的活性氧积累导致线粒体基因组的突变频率增加。而在Terc-/- ntES细胞中,这些线粒体的功能缺陷是有明显改善的。有趣的是,Terc-/- iPS细胞的线粒体功能异常不是由PGC-1α的表达抑制引起的。但是在Terc-/- iPS细胞的分化过程中,PGC-1α的激活被抑制影响了线粒体的成熟。而在Terc-/- ntES细胞的分化过程中,PGC-1α 的表达升高足以使细胞内的线粒体分化为成熟的线粒体。他们的工作表明核移植技术重编程有端粒和线粒体功能缺陷的供体细胞的能力比诱导型多能干细胞技术更强。将来的研究可利用核移植技术发现新的重编程因子,从而优化现在的诱导型多能干细胞技术,提高来自端粒和线粒体功能异常的病人的iPS细胞的质量。
该项研究由高绍荣博士实验室和杭州师范大学衰老研究所鞠振宇实验室合作完成。高绍荣博士和鞠振宇博士是本文的共同通讯作者。高绍荣实验室的博士研究生乐融融为本文的第一作者,其他作者还包括寇朝晖,蒋永华,李明,刘文强,黄波,李慧,寇晓晨;这项研究还得到了何万中博士和德国莱布尼兹研究院老年病研究所的Karl Lenhard Rudolph博士的大力协助。这项研究获得了科技部和国家自然基金的资助,在北京生命科学研究所完成。(生物谷Bioon.com)
生物谷推荐的英文摘要
Cell Stem Cell 10.1016/j.stem.2013.11.005
Enhanced Telomere Rejuvenation in Pluripotent Cells Reprogrammed via Nuclear Transfer Relative to Induced Pluripotent Stem Cells
Rongrong Le, Zhaohui Kou, Yonghua Jiang, Ming Li, Bo Huang, Wenqiang Liu, Hui Li, Xiaochen Kou, Wanzhong He, Karl Lenhard Rudolph, Zhenyu Ju, Shaorong Gao
Although somatic cell nuclear transfer (SCNT) and induction of pluripotency (to form iPSCs) are both recognized reprogramming methods, there has been relatively little comparative analysis of the resulting pluripotent cells. Here, we examine the capacity of these two reprogramming approaches to rejuvenate telomeres using late-generation telomerase-deficient (Terc-/-) mice that exhibit telomere dysfunction and premature aging. We found that embryonic stem cells established from Terc-/- SCNT embryos (Terc-/- ntESCs) have greater differentiation potential and self-renewal capacity than Terc-/- iPSCs. Remarkably, SCNT results in extensive telomere lengthening in cloned embryos and improved telomere capping function in the established Terc-/- ntESCs. In addition, mitochondrial function is severely impaired in Terc-/- iPSCs and their differentiated derivatives but significantly improved in Terc-/- ntESCs. Thus, our results suggest that SCNT-mediated reprogramming mitigates telomere dysfunction and mitochondrial defects to a greater extent than iPSC-based reprogramming. Understanding the basis of this differential could help optimize reprogramming strategies.